サステナビリティ
社会
お客さまとのかかわり
独自技術による高品質な医薬品・サービスで、
社会に価値を提供します。
久光製薬グループは「サロンパスⓇ」の開発以来、お客さまのニーズにすみやかに対応し、商品開発・改良を続けてきたことと同時に、この貼付剤技術をはじめとしたTDDSの技術に磨きをかけ、医療用医薬品、一般用医薬品、スキンケア商品などさまざまな商品を生みだしてきました。今後は貼付剤による「貼る文化」を世界に広めることにとどまらず、「手当て」の文化を世界へ広げ、お客さまのニーズに即した商品をスピーディにお届けできるよう、国内外で研究開発を行います。「手当て」の思いにあふれた商品により「世界の人々のQOL向上を目指す」ことを常に考え、より効果的で安全性の高い商品・サービスを世界中に提供していきます。
社会へ提供する価値
久光製薬は創業以来「お客様第一主義」の基本方針を掲げ、「安定して薬剤が投与できる」「貼り心地が良い」貼付剤を中心に、お客さまのニーズに応える商品開発に取り組んできました。また、顧客や医療関係者の皆さまに商品の優位性を直接お伝えする「実宣活動」やバリューチェーンの連携を通じて、顧客ニーズを迅速に商品に反映させ、高齢化など社会環境の変化にも速やかに対応しています。今後も環境や社会に寄与する価値創造を継続しながら、日本で培った技術をグローバルに展開し、健康で豊かな生活に寄与する新たな価値を世界に提供していきます。
研究開発
研究開発本部では、長年培ってきたTDDSの基盤技術プラットフォームを軸に、皮膚からの吸収が困難な薬剤のTDDS化に取り組んでいます。血中薬物濃度の持続化によりもたらされる安定した効果と副作用の低減といったTDDS製剤のメリットを最大限に活かし、既存品や競合品と明確に差別化された医薬品の研究開発・改良を行っています。
また、世界市場に医薬品をいち早く投入していくため、国内の研究開発拠点と海外子会社(ノーベン社)との研究開発活動の一元化を図り、開発パイプラインの期間短縮に努めています。
研究開発体制の充実
研究開発本部は、新商品の上市と既存商品の価値向上(効能追加、商品改良など)を主要なミッションとしています。第7期中期経営方針の達成、そして久光製薬グループの持続的な成長を確かなものとするため、私たちはこれまでの研究開発体制をSAGAグローバルリサーチセンターを中核としたグループ研究開発体制へと再構築しました。海外における医療用医薬品の開発においても、薬事部門と緊密に連携し、円滑な展開を図っています。また、研究部門体制を5つのユニットに改編したことに加え、SAGAグローバルリサーチセンターでのオープンイノベーションの積極的な推進、湘南ヘルスイノベーションパークでの最新情報の収集、そしてノーベン社を通じたFDA(米国食品医薬品局)への対応を中心とした連携など、総合的な研究開発基盤の整備が進展しました。


| 2024年度の現状 | 取り組むべき課題 | 主なステークホルダー | 2025年度の取り組み |
|---|---|---|---|
| 海外展開の進展 | 海外展開国での 関連制度への対策 |
関連行政当局・ 医療関係者 |
関連機関との関係構築 社内関係部署との連携 |
| グループ内担当者間の連携強化 | 従業員 | グループ研究員の コミュニケーション充実 |
|
| パイプラインの充実 | オープンイノベーションの進展 | パートナー、従業員 | SAGAグローバルリサーチセンターの活性化 研究機関・ベンチャー等の探索・連携強化 |
新たな研究開発体制の構築
研究開発本部の主要なミッションは、新しい商品を世に出すことと、既存商品の育薬(効能追加、商品改良)です。第7期中期経営方針の達成とさらに久光グループの将来性を確たるものにするため、これまでの研究開発体制をSAGAグローバルリサーチセンターを中心としたグループ研究開発体制とする再構築を進めています。
研究開発体制としては、これまでの研究部門を5つのユニットに組織改編しました。これにより、基礎的な研究、開発、試験など、さまざまなモダリティへの対応を含め、より効率的に推進していきます。
グループのグローバル展開に対しては、 SAGAグローバルリサーチセンターを中心に、各国、市場の動向や法規制を踏まえた機動的な開発の推進を図っていきます。
さらに、湘南ヘルスイノベーションパークでの関係者との連携や、オープンイノベーションの推進を進め、知財管理に関してもより戦略的に進める体制としています。
研究開発を高める5つのユニット

医薬品の開発
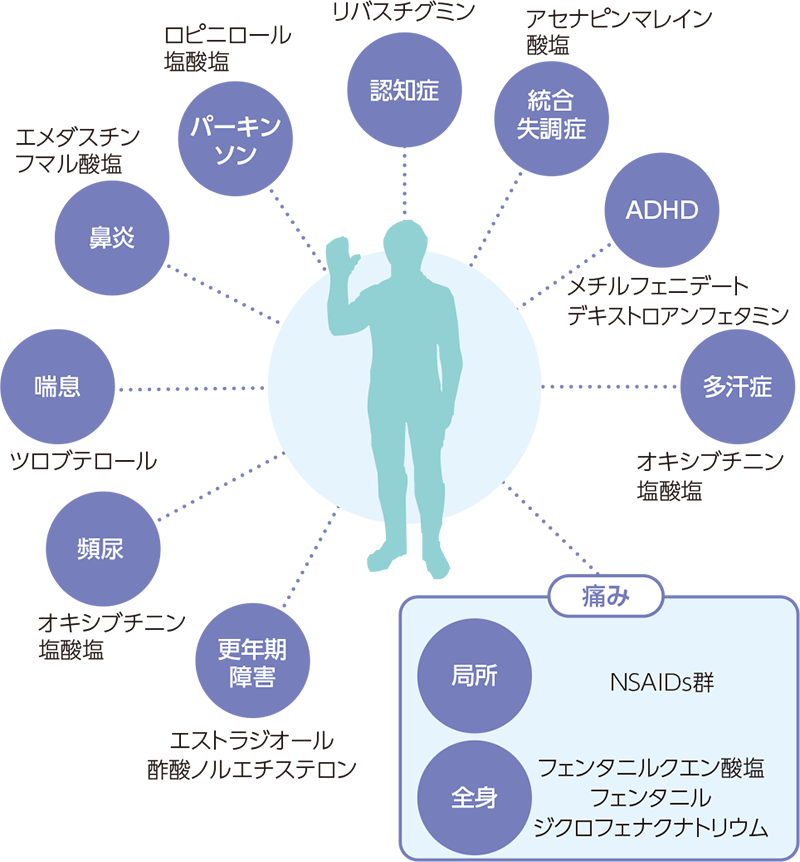
久光製薬グループは、「世界中の人々の健康・安全・快適な生活」という根源的な願いに応えるべく、TDDS製剤の研究開発に注力しています。貼付剤、塗布剤などの外用剤は、薬物血中濃度を長時間安定的に維持できるだけでなく、小児や高齢者など嚥下困難な患者さんへの投与を可能にし、さらには副作用発現時に容易に投与を中断できるといった利点があります。これにより、診療科を問わず幅広い医療ニーズに応えることができます。研究開発においては、候補薬物の網羅的な探索と積極的なアライアンスを推進し、有用性の高いTDDS製剤の開発に努めています。さらに、高分子薬物やワクチンなど、より幅広い薬物をTDDS化するためのマイクロニードルといった新規基盤技術も積極的に活用し、医療現場のニーズに合致した医薬品開発を進めています。
TDDS技術で『「手当て」の文化を、世界へ。』
TDDS(経皮薬物送達システム)の新たな技術として注目されているのがマイクロニードルです。これは、従来の製剤では実現が難しかった即効性と投与時の低侵襲性を両立する画期的な薬物送達システムです。私たちは、マイクロニードルの特性を活かした新たな治療領域への拡大に加え、心地よい皮膚刺激感を応用した化粧品分野への展開も進めています。これらの開発品については、他社との提携も視野に入れ、事業化に向けた準備を進めています。
従来の貼付剤においても、多様な疾患に対応する商品の提供を継続しています。具体的には、原発性手掌多汗症治療剤「アポハイドⓇローション」、経皮吸収型持続性疼痛治療剤「ジクトルⓇテープ」、経皮吸収型ドパミン作動性パーキンソン病治療剤「ハルロピⓇテープ」といった商品に続く、新たなラインナップの提供を図っています。
一方で、私たちは、「手当て」という思いを大切にし、皆さまのQOL(生活の質)向上に貢献する多様な商品・サービスの開発も検討しています。その一環として、健康食品や治療アプリといった新たな領域への挑戦も開始しました。
米国における医療用医薬品の開発では、変形性膝関節症を適応症として開発を進めていた経皮鎮痛消炎剤HP-5000(一般名:ジクロフェナクナトリウム)に代わり、「ジクトルⓇテープ」の海外展開を加速させるため、新たにHP-3150(一般名:ジクロフェナクナトリウム)を慢性腰痛症における鎮痛の適応症で臨床開発を進めています。
また、経皮吸収型注意欠如・多動症治療剤「XELSTRYMⓇ」(開発コード:d-ATS、一般名:d-アンフェタミン)は、2023年の米国での販売開始以来順調に売上を伸ばしており、2025年度には前期比で大幅な増大を達成しました。
久光製薬TDDSの対象疾患の拡がり
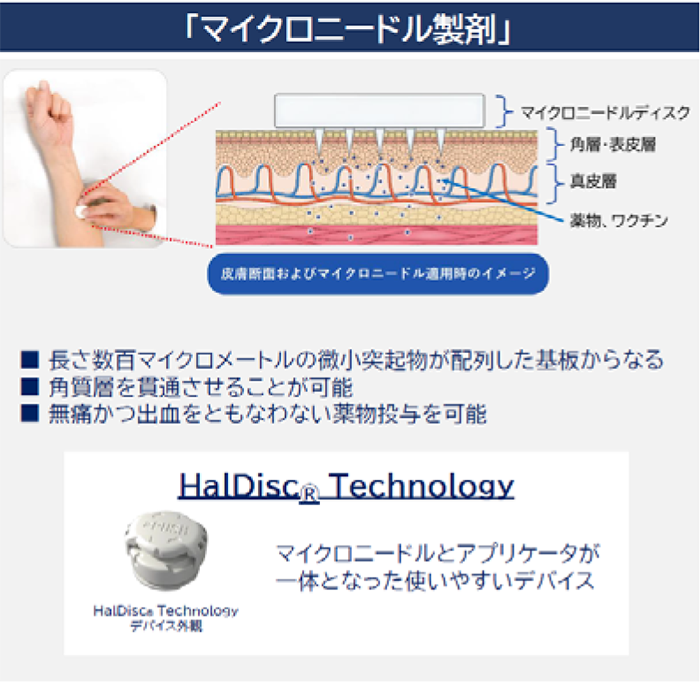
マイクロニードル技術
HalDiscⓇ Technology
(剣山型マイクロニードル技術)
ワクチンなど注射剤として投与されている高分子薬物の投与を実現し、かつ、だれでも簡便に自己投与できる技術
SheetifyⓇ Technology
(シート型マイクロニードル技術)
久光製薬独自のシート状デバイスで、高用量の経皮投与を実現する技術
HalDisc beauteⓇ
(化粧用マイクロニードル技術)
経皮吸収技術と微小突起物基板を組み合わせた心地よい刺激感を生み出す化粧用ハイブリッド技術
HP-6050(マイクロニードル製剤)
従来の注射剤に比べて、より安全かつ簡便に薬剤を経皮的に投与できるというHalDiscⓇ Technologyの特長を活かし、せん妄、精神運動興奮状態、易怒性を呈する患者さんに対する鎮静処置の治療薬として開発中です。処置の安全確保のための拘束を軽減する等、医療従事者と患者さんの双方の負担軽減に貢献することが期待されます。なお、本剤が承認された場合、医療用医薬品として世界で初めてのマイクロニードル製剤となります。
医薬品の改良
医薬品の改良においては、「お客さまからのご意見(ニーズ)」、「最新の製造技術」、「研究開発の成果」を主要な観点とし、お客さまのQOL向上を目指して、製剤のサイズや形状の選定、利用回数の低減などに継続的に取り組んでいます。これまで「つくる側」と「使う側」の視点が中心でしたが、久光製薬グループとしてESG推進やSDGsに取り組むなかで、新たな視点も積極的に取り入れることが重要だと考えています。具体的には、CO₂排出量削減や資源循環への影響改善を目的としたECO商品への改良に積極的に取り組んでいきます。環境負荷低減策の一つとして、商品で使用するプラスチック削減をテーマとする分科会をサステナビリティ推進委員会に設置し、研究開発、生産が中心となって推進しています。加えて、オープンイノベーションの観点から、サプライヤーとの協業を進め、幅広い技術情報を活用しています。
医療用医薬品の包装における配慮
医薬品全般、特に医療用医薬品において、環境への配慮は重要な経営課題であると認識しています。久光製薬では、医薬品の包装に対しても環境影響を考慮した開発と改良を継続的に進めています。その成果の一つとして、2023年には「モーラスⓇテープ20mg」および「モーラスⓇテープL40mg」の包装袋が、公益社団法人日本包装技術協会主催の日本パッケージングコンテストにおいて適正包装賞を、木下賞において包装技術賞を受賞しました。これは、従来品と同等の品質を確保しながら環境負荷低減を実現した点が評価されたものです。今後も、次の取り組みを通じて、医薬品の安定供給と環境保護の両立を目指し、持続可能な社会の実現に貢献してまいります。
- ●リサイクルPETの採用促進
- ●材質構成の変更に伴う包装袋の薄肉化など、投入資源量の削減
- ●生産工程におけるエネルギー使用量の低減
- ●プラスチック使用量の削減
木下賞:日本包装技術協会第二代会長故木下又三郎氏の包装界に対する多年の功績を記念して創設された表彰事業です。
日本パッケージングコンテスト:材料、設計、技術、適正包装、環境対応、デザイン、輸送包装、ロジスティクス、販売促進、アイデア等あらゆる機能からみて年間の優秀作品(グッドパッケージング賞)を選定するものです。

「包装技術賞」受賞

「適正包装賞」受賞
医薬品開発のおける倫理的対応について
倫理的・科学的な臨床試験の実施
久光製薬グループは、臨床試験に参加される患者さんの人権と安全の確保を最優先に考えています。そのため、医薬品医療機器等法およびGCP(医薬品の臨床試験の実施の基準)を厳守して治験実施計画書を作成し、患者さんからはインフォームド・コンセントを必ずいただいています。
また、社内には「社内治験審査委員会」を設置し、社外の医学専門委員を交え、試験の倫理的および科学的な妥当性を厳格に評価しています。海外での臨床試験においても、ICH-GCP(医薬品規制調和国際会議のガイドライン※)を遵守するとともに、各国・地域の規制要件やガイドラインに従って実施しています。
今後、医薬品開発における倫理的な社会要請はますます高まると認識しており、私たちはグローバルな動向や市民意識を常に踏まえ、適切な対応を図っていくことが重要だと考えています。
※ ICH-GCP:日米EU医薬品規制調和国際会議(ICH)において合意された、治験・臨床試験の遂行に関する国際的なGCPガイドライン。
動物福祉への倫理的配慮
久光製薬では、動物福祉の精神を徹底し、動物福祉へ配慮した適正な動物実験が実施されるよう「動物の愛護及び管理に関する法律」に準拠した「動物実験指針」を制定しています。
薬の有効性や安全性を確認する動物実験を行う場合、すべての実験を「動物実験委員会」で審査することを制度化しており、3Rの理念(Replacement:代替法の選択、Reduction:動物数の削減、Refinement:苦痛の軽減)のもと研究を進めています。動物実験の実施体制については、定期的な自己点検に加えて、第三者機関による審査を受け、2025年7月にはSAGAグローバルリサーチセンターにおいても動物実験実施施設認定を取得しました。
調達
調達部門では、原材料の品質および安定調達の確保、コスト削減、納期厳守のみならず、サプライチェーンの改善やサプライヤーからの情報収集・社内共有を図っています。久光製薬では、商品の企画・研究段階から調達部門と関連部門が連携し、原材料について議論することで、安定供給体制を構築するとともに、お客さまのニーズに速やかに応える商品開発を可能にしています。
2021年に「サステナビリティ調達ガイドライン」として制定した当社の調達基本方針である「サステナビリティ調達基本方針」および「サプライヤーのサステナビリティ調達基準」に沿った取り組みを進めております。さらに2023年には「パートナーシップ構築宣言」を公表しました。サプライチェーンの取引先や価値創造を図る事業者の皆さまとの連携・共存共栄を進めることで、新たなパートナーシップの構築を目指しています。各国地域の法規制はもちろん、サプライチェーン上の人権リスクやハラール対応など多くの国の人々が安心して商品を使用できる適切な原材料の選定を行っています。
パートナーシップ構築宣言

当社は内閣府や中小企業庁などが推進する「未来を拓くパートナーシップ構築推進会議」の趣旨に賛同し「パートナーシップ構築宣言」を2023年7月26日に公表いたしました。サプライチェーンの取引先や価値創造を図る事業者の皆さまとの連携・共存共栄を進めることで、新たなパートナーシップの構築を目指します。詳細は下記添付PDFをご確認ください。
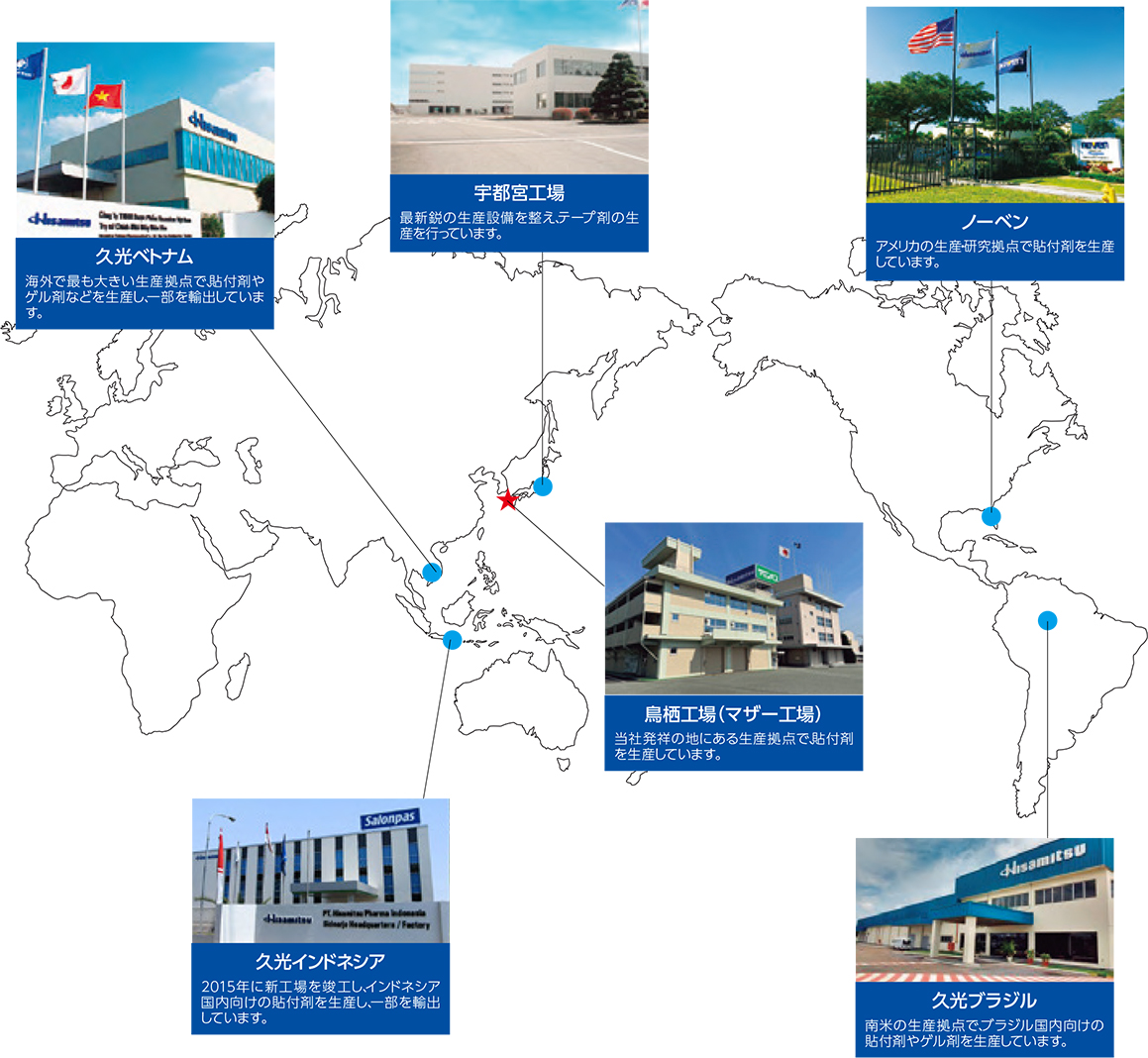
生産
国内生産拠点は、GMPに適合した鳥栖工場(佐賀県)および宇都宮工場(栃木県)の2工場を生産の基盤とし、海外工場も含めて商品の安定供給体制を構築し、日々生産性向上に取り組んでいます。本部内においては、セクションの垣根を越えたメンバーでチームをつくり、品質と生産性向上を目的とした「カイゼン活動」を継続的に行っております。さらに、「カイゼン活動」のグローバルな水平展開を推進するため、「Hisamitsu KAIZEN Awards」を開催し、海外子会社工場を含めて、従業員に「カイゼン活動」に対する意識向上をはかっております。このような活動が各国の工場の刺激となり、技術の競争を生むことで、久光製薬グループをますます発展させていきたいと考えております。
Good Manufacturing Practice(適正製造基準)
物流
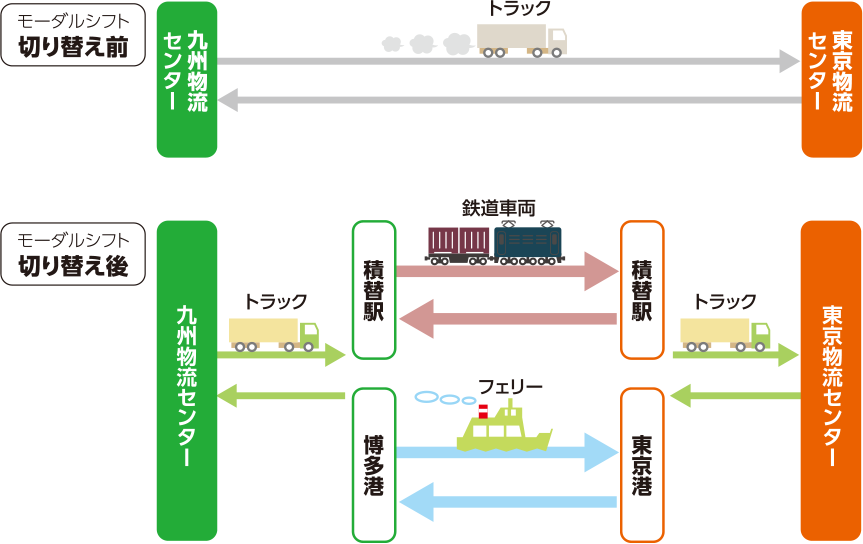
国内物流センターとして、東日本(埼玉県久喜市)、西日本(佐賀県鳥栖市)に加え、2024年4月から関西物流センター(京都府久世郡久御山町)を設置し、医薬品をより安定的に供給できる物流体制を確立しました。
各センターには管理薬剤師を配置して医薬品の品質管理に努めるとともに、出荷量の情報を工場と共有しています。これにより、多種多様な医薬品を適切に保管・管理し、お客さまへの安定供給を実現しています。また、輸送効率の向上と環境負荷低減にも積極的に取り組んでいます。これまでのトラック輸送に加え、環境負荷の少ない鉄道車両や船舶輸送へのモーダルシフトを実施しています。今後も継続的なモーダルシフトの拡大や積載効率の向上などにより、輸送効率の一層の改善に努めてまいります。
主要輸送経路における鉄道車両・
船舶へのモーダルシフト
営業/マーケティング/サービス
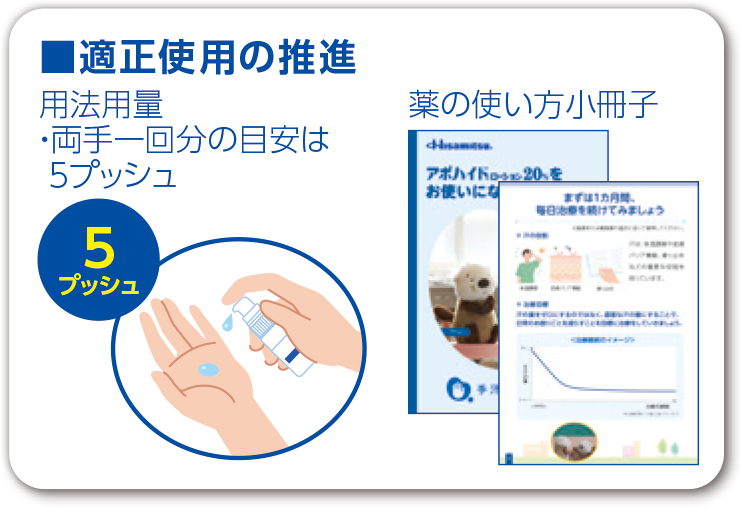
営業/マーケティング/サービスでは、医療関係者・患者さんに安心して医薬品をお使いいただけるよう、有効性・安全性などに関する情報を提供・収集し、医薬品の適正使用の推進に努めています。また、MRが収集した医療関係者からの要望などを関連部署と共有することで、商品のさらなる改善につなげるとともに、一般用医薬品事業では商品の優れた点を消費者に直接伝えるためにサンプリングを行う「実宣活動」なども推進しています。
医療現場の患者さんだけでなく、世界中の人々の健康の維持・増進に貢献しています。
<国内>医療用医薬品事業
原発性手掌多汗症にかかわる情報の提供の継続
原発性手掌多汗症は「体質だから仕方ない」と諦められがちでしたが、現在では治療可能な疾患であるという認識が、患者さんご本人だけでなく、医療関係者やその周囲の方々にも確実に広まっています。これは、多くの患者さんのQOL(生活の質)向上に大きく貢献していると実感しています。
しかしながら、社会全体での認知度はまだ十分とは言えません。この疾患が治療可能であり、QOL向上に大きく寄与することを、より多くの患者さんや医療関係者に深く理解していただく必要があります。
そのため、久光製薬は多角的な情報提供活動を継続しています。TVCMやWebCM、Web市民公開講座などを通じた疾患啓発活動により、患者さんだけでなく社会全体の認知度アップを図っています。
また医療関係者に対しては、より適切な情報を提供できるよう、MR(医薬情報担当者)の教育体制を整備し、質の高い情報提供に努めています。さらに、医療関係者の方々に原発性手掌多汗症の症状を疑似体験いただく勉強会を実施することで、疾患の認知と理解を深める取り組みも行っています。

<国内>一般用医薬品事業
「返品ゼロ」などエシカル施策の推進
近年、環境問題や人権など倫理的側面への配慮を重視するエシカル消費が広がりを見せており、メディアやSNSを通じてその重要性と波及効果は拡大しています。このような社会的な潮流の中で、久光製薬は以前より一般用医薬品事業における大きな課題であった「返品」問題に積極的に取り組んでまいりました。
医薬品業界における返品は、製薬企業のみならず、小売店、卸売企業を含む市場全体の商慣習にも起因する複雑な課題でした。しかし、2024年度には、これまでの卸売企業や小売流通業界との強固なパートナーシップを基盤に、バリューチェーン全体での協働を推進した結果、「返品ゼロ」という画期的な目標を達成することができました。
これは、資源の無駄をなくし、サプライチェーン全体の効率化を図ることで、持続可能な社会への貢献を具体的に示すものです。今後は、既存の「HELLO! eco!」マークの取り組みをさらに発展させ、エシカルな事業活動を一層強化してまいります。そして、これらの成果に関する情報も積極的に開示し、社会とのコミュニケーションを深めてまいります。




今後の展開を踏まえた人材育成の重要性
市場の変化をいち早く捉え、グローバルな視点で適切な対応策を講じるためには、それを支える人材育成が不可欠です。久光製薬は、情報発信やビッグデータ活用を担うデジタル人材、物流や情報分析に基づく戦略構築を行うスペシャリストに加え、チームとして機能するジェネラリストのバランスが重要であると考えています。育成においては、各種スキル習得のためのプログラムはもちろんのこと、経営理念である「世界の人々のQOL向上を目指す」を体現するための意識醸成といった包括的な育成プログラムが必須となります。また、適切なジョブローテーションを通じて経験値を高めることも重要です。さらに、都市部への集中といった地域差への対応や、ワークライフバランス、ダイバーシティといった労働環境整備も同時に進めていく必要があります。当社は、これらの施策を通じて個々人の成長と組織全体の成長を両立させる人材育成を推進していきます。




<海外>医療用医薬品・一般用医薬品事業
グローバルなパートナーシップの構築
海外での事業展開を拡大していく上で、各国におけるパートナーシップの構築は国内以上に重要であると認識しています。当社はこれまで、各国の代理店関係者を日本へ招き、久光製薬が長年培ってきた「手当て」の文化への理解を深めてきました。また、当社商品の品質を担保する工場の見学や、相互の交流を通じて強い信頼関係を築いてまいりました。この取り組みに加えて、2023年からは各国の代理店関係者が参加するイベントを毎年行い、当社の一般用医薬品および医療用医薬品の現状と方向性について共有と理解を得ています。また、各国における今後の事業展開について活発で有益な意見交換ができ、グローバルな事業展開推進に役立っています。
今後もこのようなグローバルなパートナーシップを強化する活動を行ってまいります。

SAGAグローバルリサーチセンター訪問


集合写真
グローバルネットワークの強化に向けて
久光製薬が海外でのさらなる飛躍を遂げるためには、安定的な供給体制と盤石な営業体制の構築が不可欠です。今後も順調な進展が期待できる北米においては、久光アメリカ・ノーベン社における営業体制のさらなる強化と供給面での連携強化が重要な鍵となります。また、生産拠点を有する3つの海外現地法人である久光ベトナム、久光インドネシア、久光ブラジルからの供給力強化を進め、併せてアジア・EMEA地域※の既存国並びに新規開拓国の営業基盤整備を進めていくことで、アジア・グローバルサウスへの展開強化を進めてまいります。このような既存拠点の強化と各エリアの特性に応じたポジショニングを明確にした供給と営業体制のグローバルネットワーク構築を今後も推進し、世界の人々のQOL向上に貢献してまいります。※Europe(ヨーロッパ), the Middle East(中東)and Africa(アフリカ)の3地域

(米国 ニューヨーク)

(ベトナム ホーチミン)

(ナイジェリア ラゴス)
ハラール※対応
久光製薬は、インドネシア、マレーシアなど、多くのイスラム教徒が住む国や地域に事業を展開しています。
子会社の久光インドネシアでは、インドネシアでのハラールガイドラインに準拠し、イスラム教徒の人々が安心して当社の商品を使用することができるように、社内にハラール対応チームを設置し、宗教や地域の生活に配慮した商品づくりを推進しています。
ハラール:イスラム法において合法なもののこと

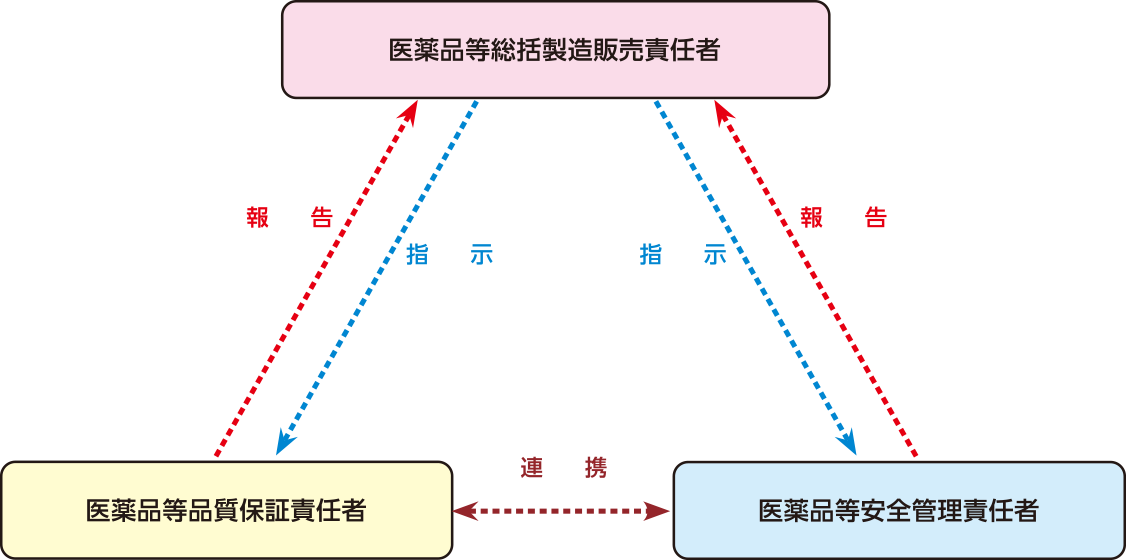
品質保証
GMPに準拠し、科学的に確立された方法で生産することで品質を保証し、医薬品の信頼性と安全性を確保します。
品質保証に関わる業務は、「生産や品質に関する工程表の作成」から 「製品の検査・ 実験・評価」、「不具合の傾向分析」、「取引先の監査・指導」、「出荷後のお客さまへの対応」まで多岐にわたります。さらには、品質保証を確実にできるようにするための製剤の開発段階から生産段階への円滑な移行体制づくりや、OEM(※)商品の製造委託先である企業の生産体制の管理・監査などを含め、社内外における品質保証に関連することにまで幅広く対応しています。
厳しい法令や自主規則の遵守状況を監視するコンプライアンス推進組織を社内に設け、また、公的機関からも品質システムの査察を受けるなど、厳格な品質管理体制のもと、常に医薬品の品質と安全性の向上に努めています。
Original Equipment Manufacture(相手先ブランド名製造)
商品の信頼性保証の取り組み
医薬品は生命に関わる商品であることから、その信頼性を確保するために研究・開発段階ではGLP※1やGCP※2、製造段階ではGMP※3、販売後はGPSP※4やGVP※5など厳しい管理基準が設けられています。久光製薬の信頼性保証本部は、商品開発の各段階における管理基準を中心に厳正に監査し、商品のライフサイクル全体をカバーする信頼性保証体制で最終的に商品の信頼性を確保しています。さらに当社のグローバル化に伴い、各国の最新の規制やガイドラインに対応するとともに、リスクアセスメントの範囲を拡大し、監査体制の強化を図っています。
※1 GLP:Good Laboratory Practice 医薬品の安全性に関する非臨床試験の実施の基準。
※2 GCP:Good Clinical Practice 医薬品の臨床試験の実施の基準。
※3 GMP:Good Manufacturing Practice 医薬品及び医薬部外品の製造管理及び品質管理の基準。
※4 GPSP:Good Post-marketing Study Practice 医薬品の製造販売後の調査及び試験の実施の基準。
※5 GVP:Good Vigilance Practice 医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準。
サプライヤー監査
2024年度は50社を超える国内外の原材料供給業者及び製品の製造委託先に対し書面・WEB監査や実地監査を行い、原材料や製造委託品の製造及び品質管理が適切に行われていることを確認しています。監査項目は原薬、原材料及び製造委託品の製造所や試験施設等それぞれの業務の重要事項を中心に設定し、GMP等で規定された内容をチェックしています。また、品質に関する変更、苦情等が発生した場合は特別監査も実施し、商品の品質と安定供給の確保に努めています。
お客さまからのお問い合わせ
久光製薬は、商品に関するお問い合わせに応える窓口として、「お客様相談室」を設置しています。当社WEBサイトを経由したお問い合わせの他に、電話や手紙によるお客さま一人ひとりの声にも対応しています。
お問い合わせに対しては丁寧に且つ迅速、的確な対応に努めるとともに、お寄せいただいたご意見やご指摘は社内の関連部署と共有を図り、商品の改良や新商品の開発に最大限活かしています。